Наиболее опасной для здоровья является кислота. Какая кислота наиболее ядовитая. Самое взрывоопасное вещество
Стремительное развитие науки позволяет ученым делать новые сенсационные открытия в области физики, химии и в других направлениях. Систематически научный мир потрясают новости о создании новых веществ с уникальными, не виденными ранее свойствами. Конечно, простые люди не всегда следят за подобными открытиями. Не все знают, что самая сильная кислота в мире была создана в Америке в 2005 году. Для многих наиболее сильным подобным химическим веществом остается серная кислота, хорошо изученная в школе.
Промышленное использование винограда направлено на получение спиртового компонента вина, в которое они пропитаны, и битартрата калия. Основная трудность обработки зависит от изменения, которое вызывает окисление или ферментация, разрушая спирт и винную кислоту. Чтобы избежать этого, хорошо поработать с маркой как можно быстрее после сжимания и держать их в специальных канавах или в силосе со специальными отверждениями, удаляя уже измененную часть и предотвращая или минимизируя контакт с воздухом.
Трудность транспортировки серого и концентрирования их в промышленных центрах означает, что их механическая обработка выполняется везде с более или менее примитивными и примитивными системами. Полученный таким образом сырой тартрат направляется на заводы винной кислоты.
Карборановая кислота – самая сильная в мире
В 2005 году ученым, работающим в Калифорнийском университете в США, удалось создать новую кислоту невиданной силы. Изобретенное соединение в миллион раз превосходит по силе концентрированную серную кислоту. Ученые в тот момент задались целью найти новую молекулу, которая станет настоящим открытием в научном мире, и им удалось добиться положительного результата.
Листы - это грязный красный кирпичный красный материал, который вино откладывается в процессе ферментации. Листы, только что удаленные из вина, вводятся в специально разработанные фильтровальные мешки, которые надлежащим образом склеиваются и подвешиваются, отпускают вино, затем выдавливают в прессе и, наконец, высушивают в воздухе. Сухие листья содержат в два раза больше влажности винных материалов. Некоторая передовая энологическая промышленность фильтрует влажную капельку в специальные фильтры и сушилку в потоках горячего воздуха.
Черепаха или репа-пемза - самый богатый винный материал; Он содержит от 40 до 80% битартрата калия и тартрата кальция. Поскольку он извлекается из бочек, он высушивается на воздухе и отправляется на заводы винтовых материалов. Производство винной кислоты. Производство винной кислоты из сырых винтовых материалов осуществляется в соответствии с общей концепцией производства органической кислоты, состоящей в отделении органической кислоты в виде нерастворимой соли, обычно кальциевой соли, разлагая ее с помощью серной кислоты и подвергать кислотный раствор очистке и кристаллизации.
Формула карборановой кислоты не отличается сложностью: H(CHB11Cl11). Но все же синтезировать такое вещество в условиях обычной лаборатории не получится. Карборановая кислота превосходит по кислотности обычную воду в более чем триллиард раз.
Уникальное свойство самой сильной кислоты
Если где-нибудь упоминается о наиболее сильной в мире кислоте, человеческая фантазия рисует вещество, которое растворяет все на своем пути. На самом деле, разрушительные свойства совсем не являются основным признаком силы химического вещества. К примеру, многие полагали, что наиболее мощной кислотой является плавиковая, поскольку она растворяет стекло. Но это далеко от истины. Плавиковая кислота разъедает стеклянную тару, но может храниться в емкостях из полиэтилена.
Сырые винные кислоты могут быть обработаны сильной неорганической кислотой, обычно соляной, так что вся винная кислота добавляется к раствору, и затем винная кислота осаждается путем нейтрализации ее известковым молоком. Так как часть винной кислоты остается в нейтрализованном растворе в форме нейтрального тартрата калия, для его осаждения необходимо добавить хлорид кальция или сульфат кальция.
Обжиг и приготовление пищи предназначены для коагуляции и нерастворимости настоящих примесей белка, а также для облегчения фильтрации и стирки. Из винных веществ также возможно отделить винную кислоту без использования минеральной кислоты. Пусть осадок кальция будет осажден, который подвергается 6-7 промывкам для декантации.

Признанная наиболее сильной в мире карборановая кислота может легко храниться в стеклянных сосудах. Дело в том, что этому химическому веществу свойственна значительная химическая стабильность. Как и другие подобные соединения, карборановая кислота, вступая в реакцию с реагентами, отдает заряженные атомы водорода. После такой реакции состав имеет незначительный отрицательный заряд и не оказывает разрушительное воздействие на окружающие материалы.
Тартрат кальция, полученный любым способом, разлагается серной кислотой в соответствии с уравнением. Операция выполняется в деревянных ваннах с свинцовым покрытием и снабжена мешалкой и катушкой для прямого нагрева. В пределах этих слайдов кальция тартрат суспендируется в 5-6 раз по весу воды, вводится 60% серной кислоты Хорошо в очень легком избытке и медленно прогревается до кипения. Он фильтруется в пресс-фильтрах и систематически извесит гипсовую пенопласт. Раствор концентрируют в вакууме, закаленный свинец или медь, покрытый мешалкой, до тех пор, пока он не начнет образовывать кристаллы, после чего его выгружают в деревянные ванны с свинцовым покрытием, снабженные мешалками, где он позволяли медленно охлаждаться под светом и непрерывным движением в течение примерно трех дней, в течение которых мелкие кристаллы сильно смешиваются с винной кислотой.
Дальнейшие работы с карборановой кислотой
Конечно, создатели карборановой кислоты стали хорошо известны в мировом научном сообществе. Более того, гениальные ученые были удостоены многих заслуженных наград за значительный вклад в развитие науки. Использование нового вещества уже не ограничивается рамками научных лабораторий: карборановая кислота используется в промышленности в качестве мощнейшего катализатора.
Затем холодную массу центрифугируют для отделения маточных растворов от кристаллов. Маточные растворы дополнительно концентрируют до нового гранулирования и так в течение трех последовательных раз; Наконец, их обрабатывают известью, и полученный тартрат кальция обрабатывают вместе со свежим тартратом.
С другой стороны, кристаллы винной кислоты растворяются в малой воде, раствор обрабатывают активированным углем, ферроцианидом кальция, сульфидом бария и т.д. для обесцвечивания и диспергирования примесей, таких как железо, серная кислота, свинец, и подвергаются медленному возможно кристаллизации в холодильных камерах.

Уникальной особенностью наиболее сильной в мире кислоты является ее способность взаимодействовать с инертными газами. Сегодня проводится множество исследований, целью которых является возможность возникновения реакции между ксеноном и карборановой кислотой. Также ученые не покладая рук работают над изучением других свойств мощнейшей кислоты.
Использует. - Свободная винная кислота используется в больших количествах для приготовления лимонадов, соков и консервов фруктов, порошков и шипучих солей, в энологической промышленности, как ткачество в тканевой печати и т.д. Изготовление тартрата калия или крема тартара. - Тартарский кремол и тартрат кальция представляют собой две формы, при которых в растениях содержится винная кислота. Экстракция крема тартара из уже описанного сырья включает три операции: отделение примесей; превращение тартрата кальция в тартрат калия; очистки неочищенных кристаллов.
Наиболее известная сильная кислота
О карборановой кислоте хорошо известно ученым. Простые люди чаще всего считают, что самой сильной является серная кислота. Это обусловлено частым использованием вещества в промышленности. Зачастую его применяют производители минеральных удобрений для получения суперфосфатов и сульфатов аммония.
Первые две операции обычно выполняются на предварительно обжаренных или нагретых автоклавных материалах для разложения альбуминоидов и облегчения операций фильтрации. Матери возвращаются к использованию для последующей экстракции, кристаллы расплавляются в горячей воде, раствор обесцвечивается активированным углем, железо измельчается ферроцианидом калия, фильтруется и подвергается кристаллизации.
Другие способы были предложены и применены для производства тартрата, которые отличаются от первого, поскольку вместо тепла для приведения тартара в раствор используют щелочные средства, такие как карбонат натрия, для превращения нерастворимого тартрата в растворимый нейтральный тартрат и из полученных щелочных растворов тартрат реактивируется путем добавления кислот. Очистка полученных кристаллов происходит так же, как в предыдущем случае.
Серная кислота широко применяется в металлургической промышленности. Ее также используют для очистки металлов от окисления. Не обходится без использования серной кислоты производство жидкого топлива. С ее помощью проводят очистку следующих продуктов:
- смазочных масел;
- керосина;
- парафина;
- минеральных жиров.

Но не только промышленное использование заставляет многих людей полагать, что серная кислота является самой сильной в мире. Подобное мнение сложилось из-за того, что вещество, попадая на плоть, обугливает ее. Такое свойство серной кислоты часто используется при съемках криминальных фильмов.
Использует. - Крестообразный кремовый крем очень широко используется в крашении, в сплошных цветах между шерстью и шелком, протравливанием на хром и т.д. в Англии и Соединенных Штатах он широко используется для приготовления «порошков для выпечки», которые используются для облегчения выпечки и делают хлеб более мягким и опухшим.
Фармакология. - Действие четырех изомерных форм винной кислоты на высшие животные организмы различно. Шабри установил, что токсичность постепенно возрастает по порядку: мезоартрическая, рацемическая, панцирная, леводопа, что соответствует различным свойствам, которые имеют кислотность фиксации кальция.
Самая сильная органическая кислота
Если говорить о самой сильной кислоте органической химии, то лидерство тут принадлежит муравьиной кислоте. Вещество так было названо из-за обнаружения его в выделениях муравьев. Муравьиная кислота имеет обширную сферу использования. Ее часто используют в медицине, поскольку она обладает анальгезирующими и раздражающими свойствами. Муравьиная кислота присутствует во многих мазях, которые применяются для лечения ушибов, варикозных расширений вен, отеков. Лекарства с этим веществом позволяют избавиться от прыщей.
Официальная итальянская фармакопея: сурьма и тартрат калия или крахмалистый зубной камень или рвотный зубной камень. Из которого готовят тантар сурьмы и калийную или масляную мазь; нейтральный тартрат калия или бипотассиальный тартар или растворимый тартар.
Обычная винная кислота является деструктарной, которая используется как освежающая и освежающая. Тартарский брезент или тартрат сурьмы и калия, также известен как рвотный зубной камень. Введенные в медицину гиасмоники, гнев врачей-галенцев считался им ядовитым ядом. Гвидо Патин и другие видные члены медицинского факультета в Париже смогли исключить из факультета коллег, которые заказывали антимониторские препараты и лишали их права заниматься профессией.

Муравьиную кислоту также широко применяют в химической промышленности. Ее используют также в сельском хозяйстве и пчеловодстве. Вещество также применяется в пище как добавка Е236.
Несмотря на свою распространенность, муравьиная кислота может представлять серьезную угрозу. Попадание концентрированного вещества на кожные покровы вызывает ожоги или сильную боль. Даже вдыхание паров муравьиной кислоты может стать причиной повреждений дыхательных путей. Но положительным свойством вещества является то, что оно быстро выводится из организма, не накапливаясь в нем.
Препараты сурьмы, которые в свое время возвращались в качестве противопожарных стимулов Расори, понемногу пали, но несправедливо, не обращая внимания. В современной терапии крахмалистый зубной камень редко используется в качестве рвотного или связанного с «ипекакуаной». Рвота имеет отраженное происхождение; из-за стимуляции желудочного нервного окончания, а не для воздействия на центр.
Они взрываются, когда вы касаетесь их. Это убьет вас миллионной грамм. Они ломают все, что у них получается. Самые опасные химикаты в мире. Фтор или хлор трифторид хлорит, ФКН формула 3, не воспламеняется, коррозионные, бесцветный газ почти сладковатый запах. В то же время данное вещество является чрезвычайно реактивным, опасным, зажигая органический материал, который имеет сильные даже удушающие и летальные эффекты.
Серная кислота - сильная двухосновная кислота, в стандартных условиях представляет собой маслянистую жидкость без цвета и запаха. Неочищенная серная кислота имеет желтоватый или буро-желтый цвет. В технике серной кислотой называют ее смеси как с водой, так и с серным ангидридом.
Основные физические свойства : температура плавления - 10,38 °C; температура кипения - 279,6 °C; плотность вещества - 1,8356 граммов на кубический сантиметр.
Предполагалось, что он был изготовлен нацистами во время Второй мировой войны и готов к военному использованию. Имперская цель состояла в том, чтобы производить вещество в несколько тонн луны в месяц и вооружать солдат с ним. Затем, с помощью хлортрифторида, им пришлось распоряжаться вражескими бункерами.
Очень мало, и вещество будет вызывать мигание различных материалов, которые затем плавятся в огромных температурах. Он также освещает кирпичи или вещи, которые сожгли один раз. Возможно, именно поэтому нацисты в конечном итоге отказались от проекта - они пришли к выводу, что сама подготовка этого вещества очень опасна.
Смешивается с водой во всех соотношениях г/100 мл. Концентрированная серная кислота является сильным окислителем. Разбавленная серная кислота взаимодействует со всеми металлами, находящимися в электрохимическом ряду напряжений левее водорода (H), с выделением Н2, окислительные свойства для нее нехарактерны.
Серную кислоту применяют: в производстве минеральных удобрений; как электролит в свинцовых аккумуляторах; для получения различных минеральных кислот и солей; в производстве химических волокон, красителей, дымообразующих и взрывчатых веществ; в нефтяной, металлообрабатывающей, текстильной, кожевенной отраслях промышленности; в пищевой промышленности (зарегистрирована в качестве пищевой добавки E513 (эмульгатор); в промышленном органическом синтезе.
С азидом азида азида у вас почти нет шансов предотвратить страшный взрыв. Он настолько чувствителен, что взрыв произойдет практически в любое время. Оставьте его без помех на стеклянной пластине. И даже иногда он взрывается даже зря. Ученые взорвались даже в темной, полностью изолированной комнате.
Это самый токсичный химикат в мире, которого мы должны избегать дугой. Короче говоря, и просто, хорошо играть с этой тканью. Если он должен быть случайно пролил, у вас есть шанс даже убирать за собой - и трения факелы во время встречи с водой взрывается.
Самый крупный потребитель серной кислоты - производство минеральных удобрений (в частности, фосфорных). Поэтому сернокислотные заводы стремятся строить в комплексе с заводами по производству минеральных удобрений.
При поступлении серной кислоты внутрь необходимо осторожное промывание желудка, затем больной должен принимать жженую магнезию или известковую воду через 5 минут по 1 столовой ложке. Полезно обильное питье воды со льдом или молока, сырой яичный белок, жиры и масла, слизистые отвары.
Поэтому мы оцениваем его среди суперкислот. Ирод все возможное, - быстро съесть через кожу и через мышцу, сжигать ваши кости и единственное, что является абсолютно безопасным, это только часы этой кислоты. Стекло, в котором хранится большая часть кислот, будет таять, как бумага.
С тех пор человечество постоянно развивается, и, несмотря на разнообразную судьбу, оно подошло к концу. Сегодня 99% людей имеют цивилизационные заболевания! Постараемся взглянуть на период времени, который может дать нам ответы на наши вопросы о том, что с нами происходит.
Материал подготовлен на основе информации открытых источников
Человек всегда стремился отыскать материалы, которые не оставляют никаких шансов своим конкурентам. Издревле учёные искали самые твердые материалы в мире , самые лёгкие и самые тяжелые. Жажда открытий привела к открытию идеального газа и идеально чёрного тела. Представляем вам самые удивительные вещества в мире.
1. Самое черное вещество
Самое чёрное вещество в мире называется Vantablack и состоит из совокупности углеродных нанотрубок (см. углерод и его аллотропные модификации). Проще говоря, материал состоит из бесчисленного множества «волосков», попав в которые, свет отскакивает от одной трубки к другой. Таким образом поглощается около 99,965% светового потока и лишь ничтожная часть отражается обратно наружу.
Открытие Vantablack открывает широкие перспективы применения этого материала в астрономии, электронике и оптике.
2. Самое горючее вещество
Трифторид хлора является самым горючим веществом из когда-либо известных человечеству. Является сильнейшим окислителем и реагирует практически со всеми химическими элементами. Трифторид хлора способен прожечь бетон и легко воспламеняет стекло! Применение трифторида хлора практически невозможно из-за его феноменальной воспламеняемости и невозможности обеспечить безопасность использования.
3. Самое ядовитое вещество
Самый сильный яд — это ботулотоксин. Мы знаем его под названием ботокс, именно так он называется в косметологии, где нашел свое основное применение. Ботулотоксин — это химическое вещество, которое выделяют бактерии Clostridium botulinum. Помимо того, что ботулотоксин — самое ядовитое вещество, так он ещё и обладает самой большой молекулярной массой среди белков. О феноменальной ядовитости вещества говорит тот факт, что достаточно всего 0,00002 мг мин/л ботулотоксина, чтобы на полдня сделать зону поражения смертельно опасной для человека.
4. Самое горячее вещество
Это, так называемый, кварк-глюонная плазма. Вещество было создано с помощью столкновением атомов золота при почти световой скорости. Кварк-глюонная плазма имеет температуру 4 триллиона градусов Цельсия. Для сравнения, этот показатель выше температуры Солнца в 250 000 раз! К сожалению, время жизни вещества ограничено триллионной одной триллионной секунды.
5. Самая едкая кислота
В этой номинации чемпионом становится фторидно-сурьмяная кислота H. Фторидно-сурьмяная кислота в 2×10 16 (двести квинтиллионов) раз более едкая, чем серная кислота. Это очень активное вещество, которое может взорваться при добавлении небольшого количества воды. Испарения этой кислоты смертельно ядовиты.
6. Самое взрывоопасное вещество
Самое взрывоопасное вещество — гептанитрокубан. Он очень дорогой и применяется лишь для научных исследований. А вот чуть менее взрывоопасный октоген успешно применяется в военном деле и в геологии при бурении скважин.
7. Самое радиоактивное вещество
«Полоний-210» — изотоп полония, который не существует в природе, а изготавливается человеком. Используется для создания миниатюрных, но в тоже время, очень мощных источников энергии. Имеет очень короткий период полураспада и поэтому способен вызывать тяжелейшую лучевую болезнь.
8. Самое тяжёлое вещество
Это, конечно же, фуллерит. Его твердость почти в 2 раза выше, чем у натуральных алмазов. Подробнее о фуллерите можно прочитать в нашей статье Самые твердые материалы в мире .
9. Самый сильный магнит
Самый сильный магнит в мире состоит из железа и азота . В настоящее время, широкой общественности недоступны детали об этом веществе, однако уже сейчас известно, что новый супер-магнит на 18% мощнее самых сильных магнитов применяющихся сейчас — неодимовых. Неодимовые магниты изготавливаются из неодима, железа и бора.
10. Самое текучее вещество
Сверхтекучий Гелий II почти не имеет вязкости при температурах близких к абсолютному нулю. Этим свойством обусловлено его уникальное свойство просачиваться и выливаться из сосуда, изготовленного из любого твёрдого материала. Гелий II имеет перспективы использования в качестве идеального термопроводника, в котором не рассеивается тепло.
Стремительное развитие науки позволяет ученым делать новые сенсационные открытия в области физики, химии и в других направлениях. Систематически научный мир потрясают новости о создании новых веществ с уникальными, не виденными ранее свойствами. Конечно, простые люди не всегда следят за подобными открытиями. Не все знают, что самая сильная кислота в мире была создана в Америке в 2005 году. Для многих наиболее сильным подобным химическим веществом остается серная кислота, хорошо изученная в школе.
Карборановая кислота – самая сильная в мире
В 2005 году ученым, работающим в Калифорнийском университете в США, удалось создать новую кислоту невиданной силы. Изобретенное соединение в миллион раз превосходит по силе концентрированную серную кислоту. Ученые в тот момент задались целью найти новую молекулу, которая станет настоящим открытием в научном мире, и им удалось добиться положительного результата.
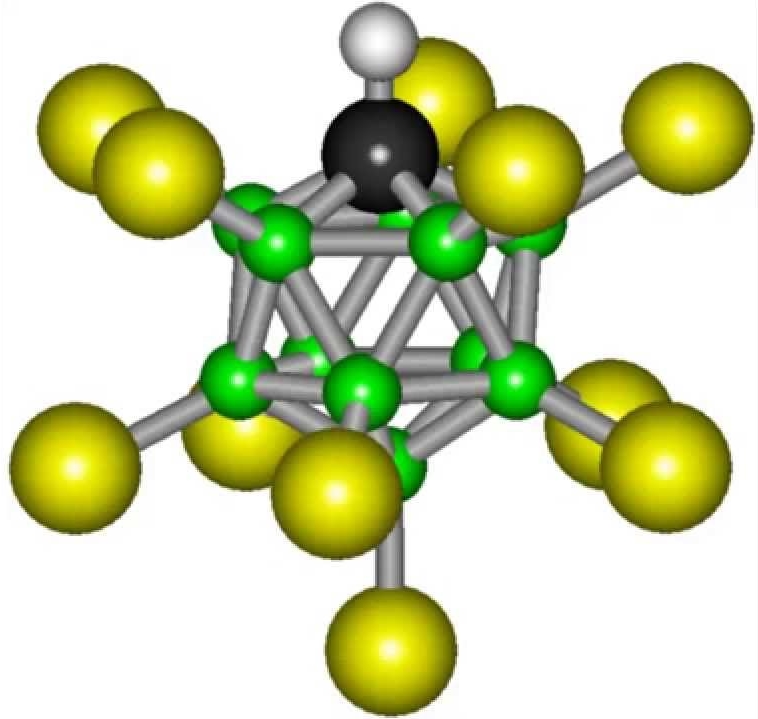
Формула карборановой кислоты не отличается сложностью: H(CHB11Cl11). Но все же синтезировать такое вещество в условиях обычной лаборатории не получится. Карборановая кислота превосходит по кислотности обычную воду в более чем триллиард раз.
Уникальное свойство самой сильной кислоты
Если где-нибудь упоминается о наиболее сильной в мире кислоте, человеческая фантазия рисует вещество, которое растворяет все на своем пути. На самом деле, разрушительные свойства совсем не являются основным признаком силы химического вещества. К примеру, многие полагали, что наиболее мощной кислотой является плавиковая, поскольку она растворяет стекло. Но это далеко от истины. Плавиковая кислота разъедает стеклянную тару, но может храниться в емкостях из полиэтилена.

Признанная наиболее сильной в мире карборановая кислота может легко храниться в стеклянных сосудах. Дело в том, что этому химическому веществу свойственна значительная химическая стабильность. Как и другие подобные соединения, карборановая кислота, вступая в реакцию с реагентами, отдает заряженные атомы водорода. После такой реакции состав имеет незначительный отрицательный заряд и не оказывает разрушительное воздействие на окружающие материалы.
Дальнейшие работы с карборановой кислотой
Конечно, создатели карборановой кислоты стали хорошо известны в мировом научном сообществе. Более того, гениальные ученые были удостоены многих заслуженных наград за значительный вклад в развитие науки. Использование нового вещества уже не ограничивается рамками научных лабораторий: карборановая кислота используется в промышленности в качестве мощнейшего катализатора.

Уникальной особенностью наиболее сильной в мире кислоты является ее способность взаимодействовать с инертными газами. Сегодня проводится множество исследований, целью которых является возможность возникновения реакции между ксеноном и карборановой кислотой. Также ученые не покладая рук работают над изучением других свойств мощнейшей кислоты.
Наиболее известная сильная кислота
О карборановой кислоте хорошо известно ученым. Простые люди чаще всего считают, что самой сильной является серная кислота. Это обусловлено частым использованием вещества в промышленности. Зачастую его применяют производители минеральных удобрений для получения суперфосфатов и сульфатов аммония.
Серная кислота широко применяется в металлургической промышленности. Ее также используют для очистки металлов от окисления. Не обходится без использования серной кислоты производство жидкого топлива. С ее помощью проводят очистку следующих продуктов:
- смазочных масел;
- керосина;
- парафина;
- минеральных жиров.

Но не только промышленное использование заставляет многих людей полагать, что серная кислота является самой сильной в мире. Подобное мнение сложилось из-за того, что вещество, попадая на плоть, обугливает ее. Такое свойство серной кислоты часто используется при съемках криминальных фильмов.
Самая сильная органическая кислота
Если говорить о самой сильной кислоте органической химии, то лидерство тут принадлежит муравьиной кислоте. Вещество так было названо из-за обнаружения его в выделениях муравьев. Муравьиная кислота имеет обширную сферу использования. Ее часто используют в медицине, поскольку она обладает анальгезирующими и раздражающими свойствами. Муравьиная кислота присутствует во многих мазях, которые применяются для лечения ушибов, варикозных расширений вен, отеков. Лекарства с этим веществом позволяют избавиться от прыщей.

Муравьиную кислоту также широко применяют в химической промышленности. Ее используют также в сельском хозяйстве и пчеловодстве. Вещество также применяется в пище как добавка Е236.
Несмотря на свою распространенность, муравьиная кислота может представлять серьезную угрозу. Попадание концентрированного вещества на кожные покровы вызывает ожоги или сильную боль. Даже вдыхание паров муравьиной кислоты может стать причиной повреждений дыхательных путей. Но положительным свойством вещества является то, что оно быстро выводится из организма, не накапливаясь в нем.
Если говорить языком химии, то кислоты – это те вещества, которые проявляют способность отдачи катионов водорода, или же вещества, которые имеют возможность приема электронной пары в результате образования ковалентной связи. Однако в обычном разговоре под кислотой чаще всего понимают только те соединения, которые при образовании водных растворов дают избыток H30+. Наличие данных катионов в растворе придает веществу кислый вкус, возможность реагировать на индикаторы. В этом материале мы расскажем о том, какое вещество - самая сильная кислота, а также расскажем о других кислотных веществах.
Пентафторид сурьмы фтористоводородной кислоты (HFSbF5)
Для описания кислотности того или иного вещества существует показатель PH, который является отрицательным десятичным логарифмом концентрации ионов водорода. Для обычных веществ этот показатель находится в пределах от 0 до 14. Однако для описания HFSbF5, который называют еще “суперкислотой”, этот показатель не подходит.
Точных данных об активности данного вещества не существует, однако известно, что даже 55% раствор HFSbF5 почти в 1 000 000 сильнее концентрированной H2SO4, которая в обывательских умах считается одной из самых сильных кислот. Тем не менее, пентафторид сурьмы является достаточно редким реагентом, а само вещество создавалась лишь в лабораторных условиях. В промышленных масштабах оно не выпускается.
Карборановая кислота (H{CHB11Cl11})
Еще одна суперкислота. H{CHB11Cl11}) - самая сильная кислота в мире из тех, которые допускаются к хранению в специальной посуде. Молекула вещества имеет вид икосаэдра. Карборановая кислота гораздо сильнее серной. Она способна растворить металлы и даже стекло.
Создано данное вещество в Калифорнийском университете Соединенных Штатов Америке при участии ученых из Новосибирского института каталитических процессов. Как сказал один из сотрудников американского университета, идеей создания служило стремление создать молекулы, ранее никому не известные.
Сила H{CHB11Cl11}) обусловлена тем, что она прекрасно отдает ион водорода. В растворах этого вещества концентрация данных ионов намного выше, чем в других. Другая же часть молекулы, после отдачи водорода включает в себя одиннадцать углеродных атомов, которые и образуют икосаэдр, который является достаточно стабильной структурой, повышая коррозионную инертность.
Еще одной самой сильной кислотой является более знакомый нам фтористый водород. Промышленность выпускает ее в виде растворов, чаще всего сорока-, пятидесяти- или семидесятипроцентных. Своим названием вещество обязано плавиковому шпату, который служит сырьем для фтороводорода.
Данное вещество не имеет цвета. При растворении в H20 происходит значительное выделение теплоты. При небольших температурах HF способен образовывать слабые соединения с водой.
Вещество разъедает стекло и многие другие материалы. Для ее транспортировки используют полиэтилен. Очень хорошо реагирует с большинством металлов. Не вступает в реакции с парафином.
Достаточно токсична и оказывает наркотический эффект. При попадании внутрь может вызвать острое отравление, нарушение кроветворения, сбой в работе органов, нарушение в работе дыхательной системы.

Оказывают токсического воздействие также и пары вещества, которые могут раздражать также кожу, слизистые оболочки, глаза. При попадании на кожу сперва вызывает раздражение, но очень быстро всасывается, что вызывает необходимость обращения к специалистам для проведения лечения. Имеет мутагенное свойство.
Серная кислота (H2S04)
Мало еще какая кислота известна более, чем серная. Действительно, по объемам производства H2S04 является самой распространенной. Именно поэтому это самая опасная кислота в мире.

Вещество представляет собой сильную кислоту с двумя основами. Сера в соединении имеет высшую степень окисления (плюс шесть). Не имеет запаха и цвета. Чаще всего используется в растворе с водой или серным ангидридом.
Существует несколько способов получения H2S04:
- Промышленный метод (окисление диоксида).
- Башенный метод (получение с помощью оксида азота).
- Другие (основаны на получение вещества из взаимодействия диоксида серы с различными веществами, мало распространены).
Концентрированная H2SO4 очень сильная, однако и ее растворы представляют серьезную опасность. При нагревании представляет собой достаточно сильный окислитель. При взаимодействии с металлами происходит их окисление. При этом H2S04 восстанавливается до диоксида серы.
H2SO4 очень едкая. Она способна поражать кожу, дыхательные пути, слизистые оболочки и внутренние органы человека. Очень опасно не только попадание ее внутрь организма, но и вдыхание ее паров.
Муравьиная кислота (HCOOH)
Данное вещество представляет собой насыщенную кислоту с одной основой. Интересно, что, несмотря на свою силу, она используется как пищевая добавка. В нормальных условиях не имеет цвета, хорошо растворяется в ацетоне и легко смешивается с водой.
HCOOH опасна при высоких концентрация. С концентрацией меньше десяти процентов она оказывает лишь раздражающий эффект. При более высоких – способна разъедать ткани и многие вещества.
Концентрированная HCOOH при попадании на кожу вызывает очень сильный ожог, что вызывает серьезный болевой синдром. Пары вещества способны повредить глаза, органы дыхания и слизистые оболочки. Попадание ее внутрь вызывает серьезное отравление. Однако кислота в очень слабых концентрациях легко перерабатывается в организме и выводится из него.

При отравлениях метанолом в организме также образуется муравьиная кислота. Именно ее работа в данном процессе приводит к нарушениям зрения из-за повреждения зрительного нерва.
Данное вещество содержится в небольшом количестве во фруктах, крапиве, выделениях некоторых насекомых.
Азотная кислота (HNO3)
Азотная кислота является сильной кислотой с одной основой. Хорошо смешивается с H20 в различных пропорциях.
Данное вещество является одним из самых массовых продуктов химической промышленности. Существует несколько методов ее получения, однако чаще всего применяется окисление аммиака в присутствии платинового катализатора. Используется HNO3 чаще всего при производстве удобрений для сельского хозяйства. Кроме того, ее используют в военной сфере, при создании взрывчатки, в ювелирной промышленности, для определения качества золота, а также при создании некоторых лекарств (например, нитроглицерина).

Вещество очень опасно для человека. Пары HNO3 повреждают дыхательные пути и слизистые оболочки. Кислота, попавшая на кожу, оставляет после себя язвы, которые очень долго заживают. Также кожный покров приобретает желтый оттенок.
Под воздействием высокой температуры или света HNO3 распадается до диоксида азота, который является достаточно токсичным газом.
HNO3 не вступает в реакции со стеклом, поэтому именно этот материал используют для хранения вещества. Впервые кислота была получена алхимиком Джабиром.
Многие пытаются выяснить для себя ответ на вопрос о том, какая она - самая сильная кислота . Разобраться в этом не очень сложно, однако необходимо почитать специальную литературу. Для тех, кто хочет просто узнать ответ на данный вопрос, написана эта статья.
Многие считают, что самая сильная кислота - плавиковая, ведь она способна растворять стекло. Это суждение практически необосновано. В понимании иных самая сильная кислота - серная. Последнее утверждение имеет вполне логическое объяснение. Дело в том, что серная кислота является очень сильной среди тех, которые применяются в промышленности. При контакте с живой тканью она способна обугливать плоть, оставлять сильные ожоги, которые заживают долго и проблематично. Её производство не требует особых материальных затрат. И можно с уверенностью утверждать, что она не является самой сильной. Науке известны так называемые суперкислоты. Речь о них пойдёт далее. А на бытовом уровне самой распространённой из сильных кислот является всё же серная. Именно поэтому она представляет опасность.
Так как же кислота может быть сильной и нежной? Ответ заключается в том, как химики определяют прочность кислоты. Кислотная прочность - это способность кислоты добавлять ион водорода к основным молекулам. Другим примером является выбор кислоты для очистки известковых отложений внутри медного чайника, отметил он. Мудрый домовладелец выбирает соляную кислоту, а не азотную кислоту, потому что хлорная часть хлористоводородной кислоты не нападает на меди, тогда как нитратная часть азотной кислоты растворяет чайник в беспорядке токсичных коричневых паров.
Многие современные ученые-химики считают, что самая сильная кислота в мире - карборановая. Это подтверждено результатами тщательных исследований. Данная кислота мощнее серной концентрированной более чем в миллион раз. Её феноменальным свойством является способность храниться в пробирке, которым не обладают многие другие вещества из упомянутого ряда. Химический состав , который считался самым едким, не мог сохраняться в стеклянной таре. Дело в том, что карборановая кислота обладает значительной химической стабильностью. Как и другие подобные ей вещества, при реакции с иными реагентами она жертвует им атомы водорода с зарядами. Однако оставшийся после реакции состав, хоть и имеет отрицательный заряд, но является очень устойчивым и не может действовать далее. Карборановая кислота имеет несложную формулу: H(CHB 11 Cl 11). Но добыть готовое вещество в обычной лаборатории непросто. Стоит отметить, что она кислее обычной воды более чем в триллиард раз. По словам изобретателя, данное вещество появилось в результате разработки новых химикалий.
Новые «сильные, но нежные» кислоты называются карбонатными кислотами. Секрет их силы двоякий. Самое главное, что карбонатная часть кислоты является чрезвычайно слабым основанием, слабее, чем фторсульфатная часть фторсерной кислоты, которая была предыдущим рекордным держателем для самой сильной кислоты. Во-вторых, карбораны обладают исключительной химической стабильностью.
По словам Рида, у них есть икосаэдрическое расположение одиннадцати атомов бора плюс один атом углерода, который, вероятно, является наиболее химически устойчивым кластером атомов во всей химии. Это означает, что карборановая часть кислоты не может участвовать в химии коррозии и разложения, которую показывают фторид и нитрат в плавиковой кислоте и азотной кислоте. В результате кислоты карборана могут добавлять ионы водорода к слабоосновным молекулам, не разрушая часто деликатные положительно заряженные молекулы, которые образуются.
Фтористоводородную, плавиковую и другие сильные кислоты список самых едких веществ содержит. Промышленные реагенты туда не входят. Однако всё же необходимо опасаться таких распространённых кислот, как серная, соляная, азотная и прочие. Не хотелось бы пугать кого-либо, но для осуществления посягательств на здоровье и умышленного уродования внешности используются, как правило, вещества именно из этого перечня.
Это и есть их сильные, но нежные качества, добавил Рид. Ни одна из этих положительно заряженных молекул не была «помещена в бутылку» при комнатной температуре раньше, потому что ранее используемые кислоты разлагали их. Сильные, но нежные карбонановые кислоты преодолевают эту трудность, позволяя химикам более внимательно рассмотреть важные молекулы, существование которых, как правило, мимолетно, сказал Рид. Подкисленные молекулы являются важными недолговечными промежуточными продуктами в огромном разнообразии катализируемых кислотой химических превращений, включая переваривание пищевых продуктов, улучшение бензина, образование полимера и синтез фармацевтических препаратов.
 является то, что среди жирных кислот, которые содержатся в продуктах питания, самой сильной является муравьиная. Она часто применяется для консервации овощей и в медицинских целях, но только в форме раствора.
является то, что среди жирных кислот, которые содержатся в продуктах питания, самой сильной является муравьиная. Она часто применяется для консервации овощей и в медицинских целях, но только в форме раствора.
Необходимо ещё раз сказать, что самой сильной кислотой является карборановая. Но на сегодняшний день необходимо больше опасаться веществ, которые используются в промышленности и быту. Химия - довольно полезная и сложная наука, но широкое производство несложных составов не требует особых знаний, а посему и кислоту добыть в достаточном количестве просто. Это создаёт повышенную опасность в случае неаккуратного обращения или реализации плохих намерений.
Насколько сильны кислоты карборана? Самый сильный из них, по крайней мере, в миллион раз сильнее, чем концентрированная серная кислота, и в сотни раз сильнее, чем предыдущий рекордсмен, фторсерная кислота. Концентрированная серная кислота уже более чем в миллиард раз сильнее разбавленной кислоты бассейна или кислоты в желудке. Кислотные среды, имеющие или превышающие кислотность карбонатных кислот, были достигнуты ранее добавлением пентафторида сурьмы к фторсерной кислоте, но эти смеси являются очень коррозионными и имеют другие ограничения.
Если говорить языком химии, то кислоты – это те вещества, которые проявляют способность отдачи катионов водорода, или же вещества, которые имеют возможность приема электронной пары в результате образования ковалентной связи. Однако в обычном разговоре под кислотой чаще всего понимают только те соединения, которые при образовании водных растворов дают избыток H30+. Наличие данных катионов в растворе придает веществу кислый вкус, возможность реагировать на индикаторы. В этом материале мы расскажем о том, какое вещество - самая сильная кислота, а также расскажем о других кислотных веществах.
Кислоты, которые являются такими сильными, называются суперкислотами, и они реагируют с углеводородами из нефти в процессе, называемом растрескиванием углеводородов. Это важный процесс повышения октановых уровней бензина. Новые кислоты могут стать очень важными для понимания и улучшения этого процесса, сказал Рид. Карборановые кислоты продвинули это поле еще дальше.
Наиболее известная сильная кислота
Есть много других молекул, реакции которых с традиционными кислотами беспорядочны и поэтому не очень полезны. Карборановые кислоты обеспечивают очень чистую кислотность без свирепости. Таким образом, должен быть возможен более чистый кислотный катализ реакций, важных для производства фармацевтических препаратов и нефтепродуктов.
Пентафторид сурьмы фтористоводородной кислоты (HFSbF5)
Для описания кислотности того или иного вещества существует показатель PH, который является отрицательным десятичным логарифмом концентрации ионов водорода. Для обычных веществ этот показатель находится в пределах от 0 до 14. Однако для описания HFSbF5, который называют еще “суперкислотой”, этот показатель не подходит.
Рид говорит: Наши исследования связаны с созданием молекул, которые никогда не были сделаны раньше. Карборановые кислоты позволяют нам это делать. Это истинная ценность этого исследования. Наука развивается, и в то же время студенты испытывают острые ощущения от открытия, поскольку они становятся учеными.
Университет Калифорнии, Риверсайд, является докторантным исследовательским университетом, живой лабораторией для новаторского исследования проблем, имеющих решающее значение для внутренней части Южной Калифорнии, государства и общин во всем мире. Сильная кислота определяется как значение рН, которое является силой водорода, что делает кислоту сильной. Однако значение рН не работает в порядке возрастания. Чем ниже значение рН, тем сильнее будет кислота. Шкала рН варьируется от 1 до раствора, значение рН которого меньше 7, рассматривается как кислоты, тогда как растворы с рН более 7 считаются основаниями.
Точных данных об активности данного вещества не существует, однако известно, что даже 55% раствор HFSbF5 почти в 1 000 000 сильнее концентрированной H2SO4, которая в обывательских умах считается одной из самых сильных кислот. Тем не менее, пентафторид сурьмы является достаточно редким реагентом, а само вещество создавалась лишь в лабораторных условиях. В промышленных масштабах оно не выпускается.
Список самых сильных кислот и их использование
Кислоты с величиной рН менее 1 считаются самыми сильными, а растворы, имеющие значение выше 13, считаются сильным основанием. Значение рН составляет 2 и считается одним из полезных кислот. Соль или сливки тартара, найденные в этом, развиваются естественным образом во время изготовления вина. Он смешивается с бикарбонатом натрия и коммерчески продается в качестве выпечки. Он используется при приготовлении пищи и обладает уникальным кислым вкусом.
Это факт, что он является источником алмазов, найденных на пробке бутылки или ее нижней части. Это используется как органическое соединение, и оно производится с помощью всех живых организмов. Эти сладости предупреждают о них, информируя клиентов о том, что они могут вызвать раздражение рта. Лимон, как правило, содержится в лимонах и имеет значение рН. Обычно она содержится в пищу цитрусовых, и она также действует как промежуточное звено в цикле лимонной кислоты, которое происходит в метаболизме аэробных организмов, Это сильная и съедобная кислота, которая используется в еде и напитке на вкус, например, безалкогольные напитки и лимонады.
Карборановая кислота (H{CHB11Cl11})
Еще одна суперкислота. H{CHB11Cl11}) - самая сильная кислота в мире из тех, которые допускаются к хранению в специальной посуде. Молекула вещества имеет вид икосаэдра. Карборановая кислота гораздо сильнее серной. Она способна растворить металлы и даже стекло.
Создано данное вещество в Калифорнийском университете Соединенных Штатов Америке при участии ученых из Новосибирского института каталитических процессов. Как сказал один из сотрудников американского университета, идеей создания служило стремление создать молекулы, ранее никому не известные.
Он добавляется в мороженое, где он действует как эмульгатор, который предотвращает выделение жиров. Он также действует как очищающий агент и может использоваться для удаления извести из испарителей и котлов. Он смягчает воду, что делает ее полезной при изготовлении моющих средств для стирки и мыла. Он не имеет запаха и может использоваться в косметических и диетических добавках.
Следовательно, он используется в широком спектре промышленных, а также отечественных продуктов. Серный также известен как сернистый; значение рН составляет 5 и это химическое соединение. Существует мало свидетельств того, что это существует в растворе, но оно существует в газовой фазе. Основаниями этого являются обычные анионы, бисульфат и сульфит. Это действует как восстановитель и дезинфицирующие средства. Они также действуют как мягкие отбеливатели и могут помочь тем материалам, которые уничтожаются хлорсодержащими отбеливателями.
Сила H{CHB11Cl11}) обусловлена тем, что она прекрасно отдает ион водорода. В растворах этого вещества концентрация данных ионов намного выше, чем в других. Другая же часть молекулы, после отдачи водорода включает в себя одиннадцать углеродных атомов, которые и образуют икосаэдр, который является достаточно стабильной структурой, повышая коррозионную инертность.
Значение рН составляет 5 и это минеральная кислота. Ингибитор ржавчины Пищевая добавка Используется в стоматологических продуктах Электролитный агент Диспергирующий агент Промышленный травитель Используется в домашних чистящих средствах. Это также кристаллическое твердое вещество, действует как восстановитель и имеет конъюгирующее основание.
Еще одной самой сильной кислотой является более знакомый нам фтористый водород. Промышленность выпускает ее в виде растворов, чаще всего сорока-, пятидесяти- или семидесятипроцентных. Своим названием вещество обязано плавиковому шпату, который служит сырьем для фтороводорода.
Данное вещество не имеет цвета. При растворении в H20 происходит значительное выделение теплоты. При небольших температурах HF способен образовывать слабые соединения с водой.
Он поглощает влагу из воздуха и представляет собой бесцветное кристаллическое твердое вещество. Он образует сироп и растворим в воде, когда он выделяется с высокой температурой. Это значение рН равно 0, и это бесцветная жидкость. Он используется для. Производство неорганических и органических нитратов Производство нитросоединений для удобрений Красители-промежуточные продукты Органические химические вещества Взрывчатые вещества. Если человек постоянно подвергается воздействию паров, это может вызвать химический пеномонит и хронический бронхит.
Вещество разъедает стекло и многие другие материалы. Для ее транспортировки используют полиэтилен. Очень хорошо реагирует с большинством металлов. Не вступает в реакции с парафином.
Достаточно токсична и оказывает наркотический эффект. При попадании внутрь может вызвать острое отравление , нарушение кроветворения, сбой в работе органов, нарушение в работе дыхательной системы.
Это бесцветная жидкость, которая при выпуске в воду отдает белые пары. Двумя другими названиями этой кислоты являются серная окись и серный ангидрид. Он широко используется в производстве химических веществ и взрывчатых веществ. Например, он используется при изготовлении синтетических моющих средств, медикаментов, промышленных красителей и пигментов, удобрений и т.д. длительное воздействие может оказывать негативное воздействие на здоровье и может сильно повредить организм человека.
Соляная кислота имеет значение рН. Это агрессивная и самая мощная кислота, которая в основном используется в лабораторных условиях. Образование этой кислоты осуществляют с помощью растворения хлористого водорода в воде. Он используется для многих вещей, таких как производство хлоридов, удобрений и умирающих. Другие виды использования кислоты включают текстиль, гальванизацию и изготовление резины. Если человек подвергается воздействию этой сильной соляной кислоты , то воздействие приведет к следующим вещам.


Вещество представляет собой сильную кислоту с двумя основами. Сера в соединении имеет высшую степень окисления (плюс шесть). Не имеет запаха и цвета. Чаще всего используется в растворе с водой или серным ангидридом.
Существует несколько способов получения H2S04:
- Промышленный метод (окисление диоксида).
- Башенный метод (получение с помощью оксида азота).
- Другие (основаны на получение вещества из взаимодействия диоксида серы с различными веществами, мало распространены).
Концентрированная H2SO4 очень сильная, однако и ее растворы представляют серьезную опасность. При нагревании представляет собой достаточно сильный окислитель. При взаимодействии с металлами происходит их окисление. При этом H2S04 восстанавливается до диоксида серы.
H2SO4 очень едкая. Она способна поражать кожу, дыхательные пути , слизистые оболочки и внутренние органы человека. Очень опасно не только попадание ее внутрь организма, но и вдыхание ее паров.
Муравьиная кислота (HCOOH)
Данное вещество представляет собой насыщенную кислоту с одной основой. Интересно, что, несмотря на свою силу, она используется как пищевая добавка. В нормальных условиях не имеет цвета, хорошо растворяется в ацетоне и легко смешивается с водой.
HCOOH опасна при высоких концентрация. С концентрацией меньше десяти процентов она оказывает лишь раздражающий эффект . При более высоких – способна разъедать ткани и многие вещества.
Концентрированная HCOOH при попадании на кожу вызывает очень сильный ожог, что вызывает серьезный болевой синдром . Пары вещества способны повредить глаза, органы дыхания и слизистые оболочки. Попадание ее внутрь вызывает серьезное отравление. Однако кислота в очень слабых концентрациях легко перерабатывается в организме и выводится из него.

При отравлениях метанолом в организме также образуется муравьиная кислота. Именно ее работа в данном процессе приводит к нарушениям зрения из-за повреждения зрительного нерва.
Данное вещество содержится в небольшом количестве во фруктах, крапиве, выделениях некоторых насекомых.
Азотная кислота (HNO3)
Азотная кислота является сильной кислотой с одной основой. Хорошо смешивается с H20 в различных пропорциях.
Данное вещество является одним из самых массовых продуктов химической промышленности. Существует несколько методов ее получения, однако чаще всего применяется окисление аммиака в присутствии платинового катализатора. Используется HNO3 чаще всего при производстве удобрений для сельского хозяйства . Кроме того, ее используют в военной сфере, при создании взрывчатки, в ювелирной промышленности, для определения качества золота, а также при создании некоторых лекарств (например, нитроглицерина).

Вещество очень опасно для человека. Пары HNO3 повреждают дыхательные пути и слизистые оболочки. Кислота, попавшая на кожу, оставляет после себя язвы, которые очень долго заживают. Также кожный покров приобретает желтый оттенок.
Под воздействием высокой температуры или света HNO3 распадается до диоксида азота, который является достаточно токсичным газом.
HNO3 не вступает в реакции со стеклом, поэтому именно этот материал используют для хранения вещества. Впервые кислота была получена алхимиком Джабиром.


